Teoria dysocjacji elektrolitycznej. Proste wyjaśnienie złożonych procesów
Z terminem "dysocjacji elektrolitycznej" naukowcydziała od końca XIX wieku. Jego pojawienie się należy do szwedzkiego chemika Arrheniusa. Pracując nad problemem elektrolitów w latach 1884-1887, przedstawił go w celu opisania zjawiska jonizacji w roztworach i tworzeniu się stopów. Mechanizm tego zjawiska, zdecydował się wyjaśnić rozkład cząsteczek na jony, elementy, które mają ładunek dodatni lub ujemny.
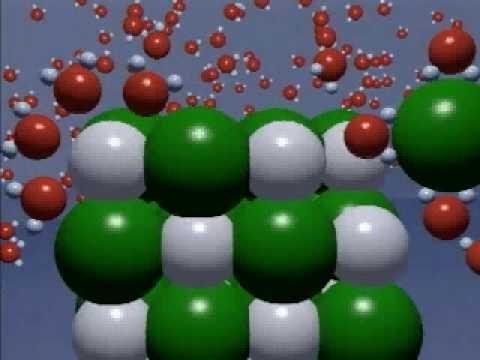
Wyjaśnia teoria dysocjacji elektrolitycznejprzewodność elektryczna niektórych rozwiązań. Na przykład chlorek potasu KCl charakteryzuje się rozkładem cząsteczki tej soli do jonu potasowego, który ma ładunek ze znakiem plus (kation) i jonem chloru, ładunek ze znakiem minus (anion). Kwas chlorowodorowy HCl rozkłada się w kation (jon wodorowy) i anion (jon chloru), roztwór wodorotlenku sodowego NaHO prowadzi do pojawienia się jonów sodu i anionu w postaci jonu wodorotlenkowego. Podstawowe tezy teorii dysocjacji elektrolitycznej opisują zachowanie się jonów w roztworach. Zgodnie z tą teorią, poruszają się one całkowicie swobodnie w roztworze, a nawet przy niewielkim spadku roztworu utrzymuje się równomierny rozkład naładowanych przeciwnie ładunków elektrycznych.
Teoria procesu dysocjacji elektrolitycznejTworzenie się elektrolitów w roztworach wodnych wyjaśniono w następujący sposób. Pojawienie się wolnych jonów wskazuje na zniszczenie krystalicznej sieci materii. Proces ten, gdy substancja jest rozpuszczona w wodzie, zachodzi pod wpływem polarnych cząsteczek rozpuszczalnika (w naszym przykładzie rozważamy wodę). Są w stanie zmniejszyć siłę przyciągania elektrostatycznego istniejącą między jonami w miejscach sieci, co powoduje, że jony przemieszczają się do swobodnego ruchu w roztworze. W tym przypadku wolne jony wchodzą w środowisko cząsteczek wody polarnej. Otoczona nimi skorupa, teoria dysocjacji elektrolitycznej wywołuje nawodnienie.
Ale teoria dysocjacji elektrolitycznej Arrheniuszawyjaśnia powstawanie elektrolitów nie tylko w roztworach. Sieć krystaliczna może również ulec zniszczeniu pod wpływem temperatury. Ogrzewając kryształ, uzyskujemy efekt intensywnej oscylacji jonów w miejscach kraty, który stopniowo prowadzi do zniszczenia kryształu i pojawienia się stopu całkowicie składającego się z jonów.
Wracając do rozwiązań, następuje to osobnorozważ właściwości substancji, którą nazywamy rozpuszczalnikiem. Najjaśniejszym przedstawicielem tej rodziny jest woda. Główną cechą jest obecność cząsteczek dipolowych, tj. gdy z jednego końca cząsteczka jest naładowana dodatnio, a z drugiej jest ujemna. Cząsteczka wody całkowicie spełnia te wymagania, ale woda nie jest jedynym rozpuszczalnikiem.
Proces dysocjacji elektrolitycznej możei spowodować niewodne rozpuszczalniki polarne, na przykład, ciekły dwutlenek siarki, ciekły amoniak, itp. Jednak, jest woda, która zajmuje główną przestrzeń w tej serii z powodu jego właściwości osłabienia (przenikania) przyciągania elektrostatycznego i zniszczyć krystalicznej wydaje się szczególnie jasne. Dlatego też mówimy o rozwiązań, to znaczy, że jest roztworem wodnym.
Dopuszczalne są głębokie badania właściwości elektrolitówprzejdź do koncepcji ich siły i stopnia dysocjacji. Stopień dysocjacji elektrolitu jest stosunkiem liczby zdysocjowanych cząsteczek do ich całkowitej liczby. Potencjalne elektrolity, współczynnik ten jest w zakresie od zera do jednej, a stopień dysocjacji, która jest równa zero wskazuje, że mamy tu do czynienia z innych niż elektrolity. Zwiększenie stopnia dysocjacji pozytywnie wpływa na wzrost temperatury roztworu.
Siła elektrolitów zależy od stopnia dysocjacjipod warunkiem stałej koncentracji i temperatury. Silne elektrolity mają stopień dysocjacji zbliżający się do jedności. Są to dobrze rozpuszczalne sole, zasady, kwasy.
Teoria dysocjacji elektrolitycznej można wyjaśnić szeroki zakres zjawisk, które są badane w ramach fizyki, chemii, fizjologii roślin i zwierząt, elektrochemii teoretycznej.
</ p>