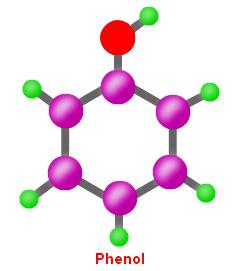
Molekularna i strukturalna formuła fenolu
Fenole są powszechną nazwą aromatycznych alkoholi. Ich właściwościami są słabe kwasy. Duże znaczenie praktyczne ma wiele homologów hydroksybenzenu C6H50H (wzór fenolu) - najprostszy przedstawiciel klasy. Przyjrzyjmy się temu bardziej szczegółowo.
Fenole. Ogólna formuła i klasyfikacja
Ogólna formuła substancji organicznych związanycharomatyczne alkohole, - R-OH. Cząsteczki fenoli i krezoli właściwe są utworzone przez rodnik - fenyl C6H5, z którym jedna lub kilka grup hydroksylowych OH (grupy hydroksylowe) są bezpośrednio połączone. Poprzez ich liczbę w cząsteczce fenole są klasyfikowane jako pojedyncze, podwójne i wieloatomowe. Monatomiczne związki tego typu to fenol i krezol. Najbardziej rozpowszechnionymi wśród wielowodorotlenowych hydroksybenzenów są naftole, które zawierają 2 skondensowane jądra w swoim składzie.

Fenol jest przedstawicielem aromatycznych alkoholi
Fenol znany był już pracownikom włókienniczym już w XVIII wieku: tkacze użyli go jako barwnika. W destylacji smoły węglowej w 1834 r. Niemiecki chemik F. Runge wyróżnił kryształy tej substancji o charakterystycznym słodkawym zapachu. Łacińska nazwa węgla to carbo, więc związek nazywano kwasem karbolowym (kwasem karbolowym). Niemiecki badacz nie określił składu substancji. Formuła molekularna fenolu została ustalona w 1842 roku przez O. Laurenta, który rozważał pochodną karbolową benzenu. W przypadku nowego kwasu użyto nazwy "fenyl". Charles Gerard stwierdził, że substancja jest alkoholem i nazywa ją fenolem. Początkowe obszary zastosowania związku to medycyna, garbowanie skóry, produkcja syntetycznych barwników. Charakterystyka substancji:
- Racjonalna formuła chemiczna - C6H5OH.
- Masa cząsteczkowa związku wynosi 94,11 a. e. m.
- Wzór brutto, odzwierciedlający skład, to C6H6O.

Elektroniczna i przestrzenna struktura molekuły fenolu
Sugerował cykliczny wzór strukturalny benzenuNiemiecki chemik organiczny F. Kekule w 1865 roku, a wkrótce przed nim - I. Loschmidt. Naukowcy reprezentowali cząsteczkę materii organicznej w postaci regularnego sześciokąta z naprzemiennymi wiązaniami prostymi i podwójnymi. Zgodnie z nowoczesnymi ideami, aromatyczne jądro jest szczególnym rodzajem struktury pierścieniowej, zwanej "sprzężonym połączeniem".
Sześć atomów węgla C przechodzi proces sp2-hybrydyzacja orbitali elektronicznych. Chmury p-elektronowe, które nie uczestniczą w tworzeniu wiązań C-C, zachodzą na siebie i pod płaszczyzną jądra cząsteczki. Istnieją dwie części ogólnej chmury elektronicznej, która obejmuje cały pierścień. Formuła strukturalna fenolu może wyglądać inaczej, biorąc pod uwagę historyczne podejście do opisu struktury benzenu. Aby podkreślić nienasycony charakter aromatycznych węglowodorów, trzy z sześciu wiązań są konwencjonalnie uważane za podwójne, które są podzielone na trzy proste.
Polaryzacja wiązania w grupie hydroksylowej
W najprostszym węglowodorze aromatycznym - benzenie C6H6 - chmura elektronowa jest symetryczna. Wzór fenolowy różni się jedną grupą hydroksylową. Obecność hydroksylu zaburza symetrię, co znajduje odzwierciedlenie we właściwościach substancji. Wiązanie pomiędzy tlenem i wodorem w grupie hydroksylowej jest kowalencyjne. Przesunięcie ogólnej pary elektronów do atomu tlenu prowadzi do pojawienia się ładunku ujemnego (częściowego ładunku) na nim. Wodór jest pozbawiony elektronu i otrzymuje częściowy ładunek "+". Ponadto tlen w grupie O-H jest właścicielem dwóch niepodzielnych par elektronowych. Jedną z nich przyciąga elektroniczna chmura aromatycznego jądra. Z tego powodu wiązanie staje się bardziej spolaryzowane, atom wodoru łatwiej zastępuje się metalami. Modele dają wyobrażenie o asymetrycznym charakterze cząsteczki fenolu.

Osobliwości interakcji atomów w fenolu
Pojedyncza elektroniczna chmura aromatycznego jądra wcząsteczka fenolu reaguje z grupą hydroksylową. Istnieje zjawisko zwane koniugacją, w wyniku którego naturalna para elektronów atomu tlenu grupy hydroksylowej jest przyciągana do układu cyklu benzenowego. Obniżenie ładunku ujemnego jest kompensowane przez jeszcze większą polaryzację wiązania w grupie O-H.
Rdzeń aromatyczny również zmienia systemdystrybucja elektroniczna. Zmniejsza się na węglu, który jest związany z tlenem, i wznosi się w pobliżu najbliższych atomów w pozycjach orto (2 i 6). Koniugacja powoduje nagromadzenie na nich ładunku "-". Dalsze przemieszczenie gęstości - ruch z atomów w meta-pozycjach (3 i 5) do węgla w pozycji para (4). Wzór fenolowy dla wygody badania koniugacji i wzajemnego oddziaływania zwykle zawiera numerację atomów pierścienia benzenowego.

Wyjaśnienie chemicznych właściwości fenolu na podstawie jego struktury elektronowej
Procesy sprzęgania aromatycznego jądra ihydroksyl wpływa na właściwości zarówno cząstek, jak i całej substancji. Na przykład wysoka gęstość elektronowa atomów w pozycjach orto i para (2, 4, 6) powoduje, że wiązania C-H pierścienia aromatycznego fenolu są bardziej reaktywne. Ujemny ładunek atomów węgla w pozycjach meta zmniejsza się (3 i 5). Atak cząstek elektrofilowych w reakcjach chemicznych poddanych działaniu węgla, umiejscowiony w pozycjach orto i para. W reakcji bromowania benzenu zachodzą zmiany przy silnym ogrzewaniu i obecności katalizatora. Powstaje pochodna monohalogeno - bromobenzen. Formuła fenolu pozwala niemal natychmiast reagować z bromem bez podgrzewania mieszaniny.
Rdzeń aromatyczny wpływa na polaryzację wiązania wgrupa hydroksylowa, zwiększając ją. Atom wodoru staje się bardziej mobilny w porównaniu z ograniczającymi alkoholami. Fenol reaguje z zasadami, tworząc sole fenolowe. Etanol nie oddziałuje z alkaliami, a raczej produkty reakcji - etanolany - rozkładają się. Chemicznie fenole są silniejszymi kwasami niż alkohole.
Przedstawiciele klasy aromatycznych alkoholi
Ogólna formuła homologu fenolu-krezolu (metylofenol, hydroksytoluen) -C7H8O. Substancja w naturalnych surowcach często towarzyszy fenolowi, ma również właściwości antyseptyczne. Inne homologi fenolowe:
- Pirokatechina (1,2-hydroksybenzen). Wzór chemiczny - C6H4(OH)2.
- Rezorcynol (1,3-hydroksybenzen) -C6H4(OH)2.
- Pyrogallol (1,2,3-trihydroksybenzen) -C6H3(OH)3.
- Naftol. Ogólna formuła substancji to C10H7OH. Stosuje się go do produkcji barwników, leków, związków zapachowych.
- Timol (2-izopropylo-5-metylofenol). Wzór chemiczny - C6H3CH3(OH) (C.3H7). Jest on stosowany w chemii syntezy organicznej, medycyny.
- Wanilina wyjątkiem fenolowej rodników zawiera grupę eterową oraz pozostałości aldehydu. Ogólna formuła dla związku to C8H8O3. Wanilina jest szeroko stosowana jako sztuczny zapach.
Formuła odczynnika do rozpoznawania fenoli
Jakościowe oznaczanie fenolu można przeprowadzić za pomocąza pomocą bromu. W wyniku reakcji podstawienia wytrąca się biały osad tribromofenolu. Pirokatechina (1,2-hydroksybenzen) jest zabarwiona na zielono w obecności rozpuszczonego chlorku żelazowego. Przy tym samym odczynniku fenol reaguje chemicznie i tworzy się trifenolan, który ma purpurowy kolor. Jakościową reakcją na rezorcynol jest pojawianie się ciemnofioletowego barwienia w obecności chlorku żelazowego. Stopniowo kolor roztworu staje się czarny. Wzorem odczynnika, który służy do rozpoznawania fenolu i niektórych jego homologów, jest FeCl3 (chlorek żelazowy).
Hydroksybenzen, naftol, tymol to wszystkie fenole. Ogólna formuła i skład substancji pozwala określić, czy związki te należą do serii aromatycznych. Wszystkie substancje organiczne zawierające w swoim wzorze rodnik fenylowy C6H5, z którymi grupy hydroksylowe są bezpośrednio związane,wykazują specjalne właściwości. Różnią się od alkoholi lepiej wyrażoną kwasowością. W porównaniu z substancjami z homologicznej serii benzenu, fenole są bardziej aktywnymi związkami chemicznymi.
</ p>